VYHODNOTENIE SKUSKY
DPMTF
| Komentár |
|---|
:: Skúška zo všeobecnej chémie mala 3 èasti a trvala cca 90 min.
|
Celkové zhodnotenie modelovania poèítaèovej podpory /TEL, CAL/
| => Samovyhodnovací test je o-key, ale php/mysql treba nejak doprogramova, resp. asi iba kombinova s papierom | (treba ráta aj s tým, že niektorých študentov rozpty¾uje písanie na klávesnici PC, | resp. to dobre nevedia a èasovo zdržuje) | - poèítaèová technika neumožòuje zatia¾ robi to, èo èlovek dokáže s papierom a ceruzkou! (neexistuje jednotný formát a obrazovka je malá)
| |
|---|
MI
DPMTF
znamena ze na jeden atom uhlika sa viazu 4 atomy vodika
Základ hybridizácie: atóm nevytvára väzbu pomocou energeticky rozdielnych atómových orbitálov.
Na obrazku je hybridizacia sp3.Lineárnou kombináciou jedného orbitálu s a troch orbitálov p vzniknú štyri energeticky rovnocenné orbitály sp3
Vo valenènej vrstve atómu kombináciou energeticky rozdielnych atómových orbitálov vytvárajú energeticky rovnocenné hybridné orbitály.
Poèet vytvorených orbitálov sa rovná poètu pôvodných orbitálov. Orbitály môžu vzniknú kombináciou len energeticky blízkych orbitálov
V prípade atómu uhlíka je v každom zo štyroch rovnocenných orbitálov sp3 jeden nespárený elektrón.
Metán je najjednoduchší uh¾ovodík. Je to pri bežných podmienkach bezfarebný plyn.
Èistý metán je bez zápachu.Metán tvorí väèsinu zemného plynu. Je tažke udržat metan pod kontrolou lebo je vybušny.
Ve¾mi dobre sa využíva ako palivo ale keïže je to plyn tažko sa prepravuje z miesta na miesto.
Doplnujuca otazka => priestorove usporiadnie CH4
Doplnujuca prezentácia => spolocne s Èupom (pozri zaznam Èupa - Skuska)
SVET
DPMTF


SVET
DPMTF

SVET
DPMTF

MI
DPMTF
V zlúèeninách sa titán vyskytuje v mocenstve Ti+3, vyskytuje sa aj v mocenstve Ti+4
pri štiepeni titánu v orbitále d dochádza k skoku o hladinu vyššie, pri štiepení sa uvolnuje energia deltaE.
k zistenie štruktúry prvku nám slúži difrakcia rôntgenového žiarenia.
táto metoda poskytuje poskytuje presné usporiadanie atomov .
teoria krystalového pola sa používa pre popis elektronového stavu v
pevných látkach .základným predpokladom tohoto modelu krystálového
pola je, že príslušné vlnové funkcie valenèných elektronov sú obsadené na jednotlivých atomoch.
energiu pri štiepení elektronu TI na Ti+3 zistíme pomocou trojèlenky kde vydelíme hodnotu 2000cm-1 èo je vlastne vlnová dlžka(frekvencia) ktorú sme vypoèítali zo vztahu lambda =energia deleno H . a hodnotu 2000 smy
videlili hodnotou 83,5cm-1 èo je vlatne hodnota vlnovej dlžky pri hodnote 1kJ .
titan sa nachádza na 4 periode a má na orbitáloch 4s2 a 3d2 za prvkom Ar ktorý ukonèuje tretiu periodu.
pri vzniku Ti+3 obsadí potom Ar + 3d1 kde obsadí len jeden elektron.
Doplòujäúca otázka - èo znamená tá "vlna" v spektre
Doplòujäúca prezentácia
=> spolu s Andrisíkom vysvetlili vzah medzi ΔG, ΔG0, koncentráciami - keï nie je rovnováha
=> keï je rovnováha, že ΔG=0 a preto
ΔG0 = - RTlnK ..., kde K = súèin koncentrácií produktov deleno reaktantov pre reakciu A+B=C+D (K=[C].[D]/[A].[B])
vysvetlili, že ak K je ve¾ká, tak ΔG0<0 a reakcia beží samovo¾ne - napr. K=1000 a log K=3
vysvetlili, že ak K je malá a jej logaritmus je záporný , tak ΔG00 a reakcia už nebude beža - napr. K=0,01 a log K=-2
Vysvetlil aj, že ak poznáme rozdiel potenciálov galvanického èlánku v štandardnom stave, tak môžem vypoèíta energiu, napr. G00=-nxFxE(st) = -2x96500x1.1 (dôkaz, že Danielov èlánok, keï má napätie 1,1 V, tak zmena Gibbsovej energie je záporná, t.j. reakcia beží samovo¾ne)
MI
DPMTF
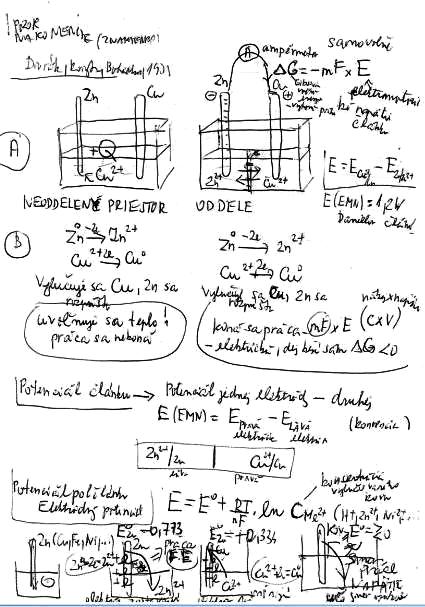
Na zinkovej elektrode ZINOK PRÍJMA 2 ELEKTRÓNY. Tento dej sa nazýva
OXIDÁCIA. Elektróda na ktorej prebieha oxidácia sa nazýva anóda.
Na medenej elektróde MEÏ ODOVZDÁVA ELEKTRÓNY. Tento dej sa nazýva
REDUKCIA. Elektróda na ktorej prebieha redukcia sa nazýva katóda.
Pri neoddelenom priestore nádob:
- vyluèuje sa meï, zinok sa rozpúša.
- sa uvo¾nuje teplo, no práca sa nekoná.
Pri oddelenom priestore nádob:
- vyluèuje sa meï, zinok sa rozpúša.
- koná sa práca: mF x E (CxV)
- dej beží sám, pretože ΔG<0
Potenciál èlánku (rovnovážne napätie èlánkov) vypoèítame ako: potenciál jedného èlánku (pravej strany) - potenciál druhého èlánku (¾avej strany).
Doplòujúca otázka - aký napätie môže dáva Danielov èlánok?
Rozdiel št. potenciálov: Cu má +0,34 V -- Zn má - 0,76 V
Napätie => +0.34 - (-0.76) = 1,1 V
Ústny výklad - Vysvetlite Balmerovu sériu pre atóm vodíka.
... prezentovala = vysvetlila ostatným prítomným na skúške, ako vzniká emisné spektrum vodíka
(vodík - sklená trubica, znížený tlak, výboj --- hranol)
a ako preskokom elektrónov z vyšších hladín (po prijatí energie od
el. výboja sa dostanú do excitovaného stavu)sa nadbytok energie vyžiari
svetelnými kvantami - fotónmi, t.j. pri každom skoku dostaneme èiaru spektra.
Èiary sa zbiehajú k hrane s nižšou vlnovou dåžkou (alebo zvyšujúcim sa vlnoètom = 1/vlnová dåžka) žiarenia.
Poznámka - všetci traj potrebovali použi aj papier, ak chceli zapísa vzahy, vzorce, nakresli schému - to je nevýhoda písania písomky cez internet
SVET
DPMTF
Optické vlastnosti - pri prechode svetla (elmag. žiarenie vlnovej dåžky 400-760 nm)=> môže dôjs k lomu svetla (svetlo letiace rýchlosou 300 tis. km/s vzduchom sa "zabrzdí" pri vniknutí do iného prostredia), ïalej sa môže pozorova optická aktivita (otáèanie roviny polarizovaného svetla), rozptyl svetla (tzv. difrakcia žiarenia), absorpcia svetla (èas dopadajúceho svetla na látku neprejde, lebo èas fotónov narazí do elektrónov, atómov, molekúl - odrazí sa a neprejde teda cez prostredie, napr. roztok)/tu platí Lambert-Bereov zákon ("zníženie priepustnosti svetla závisí úmerne od koncentrácie látky v roztoku"). Spektroskopické vlastnosti - grafy závislosti INTENZITY ("sile") elektromagnetického žiarenia na vlnovej dåžke voláme SPEKTRUM. Spektrum môže ma tvar, že napr. vidím jeden "kopec/vrch", t.j. maximum žiarenia je keï na osi x je urèitá vlnová dåžka. V praxi mením vlnovú dåžku prístrojmi. Ak "nenameriam/neuvidím kopec/vrch", znamená to, že látka neabsorbuje žiarenie danej vlnovej dåžky. Spektrá sa získavajú tak, že sa napr. látka (vodík, oxid uhlièitý, oce¾ a pod.) "rozžeraví" a potom vysiela = emituje žiarenie - môžeme teda analyzova takéto žiarenie a získame emisné spektrum. Ak najskôr necháme emitované = vysielané žiarenie prejs cez nejakú látku a analyzujeme to žiarenie, ktoré z nej vychádza (ktoré prepustila, teda neabsorbovanú èas z pôvodného žiarenia), získame absorpèné spektrum.
Poznámka - emisné, resp. absorpèné spektrá získavame tak, že necháme prejs elektromagnetické žiarenie
SVET
DPMTF
Optické vlastnosti - pri prechode svetla (elmag. žiarenie vlnovej dåžky 400-760 nm)=> môže dôjs k lomu svetla (svetlo letiace rýchlosou 300 tis. km/s vzduchom sa "zabrzdí" pri vniknutí do iného prostredia), ïalej sa môže pozorova optická aktivita (otáèanie roviny polarizovaného svetla), rozptyl svetla (tzv. difrakcia žiarenia), absorpcia svetla (èas dopadajúceho svetla na látku neprejde, lebo èas fotónov narazí do elektrónov, atómov, molekúl - odrazí sa a neprejde teda cez prostredie, napr. roztok)/tu platí Lambert-Bereov zákon ("zníženie priepustnosti svetla závisí úmerne od koncentrácie látky v roztoku"). Spektroskopické vlastnosti - grafy závislosti INTENZITY ("sile") elektromagnetického žiarenia na vlnovej dåžke voláme SPEKTRUM. Spektrum môže ma tvar, že napr. vidím jeden "kopec/vrch", t.j. maximum žiarenia je keï na osi x je urèitá vlnová dåžka. V praxi mením vlnovú dåžku prístrojmi. Ak "nenameriam/neuvidím kopec/vrch", znamená to, že látka neabsorbuje žiarenie danej vlnovej dåžky. Spektrá sa získavajú tak, že sa napr. látka (vodík, oxid uhlièitý, oce¾ a pod.) "rozžeraví" a potom vysiela = emituje žiarenie - môžeme teda analyzova takéto žiarenie a získame emisné spektrum. Ak najskôr necháme emitované = vysielané žiarenie prejs cez nejakú látku a analyzujeme to žiarenie, ktoré z nej vychádza (ktoré prepustila, teda neabsorbovanú èas z pôvodného žiarenia), získame absorpèné spektrum.
Poznámka - emisné, resp. absorpèné spektrá získavame tak, že necháme prejs elektromagnetické žiarenie
SVET
DPMTF
Spektrá emisné alebo absorbèné sa používajú na analýzu chemických látok a ich štruktúry, RTG(X-ray) ohyb/difrakcia na štruktúry kovov, org. látok - vidíme v podstate tieò a z neho sa usudzuje, aká je štruktúra (DNA - zistili, že je dvojzávitnica)
Keïže máme ve¾a typov elektromagnetického žiarena a tieto ešte môžu by prípadne aj v magnetickom poli (NMR), tsk emisných spektier alebo absorpèných je strašne ve¾a. V podstate sa molekúly, atómy rozkmitajú/"rozrotujú", rozvibrujú, elektróny exitujú a pod. a vždy sa vyžiari nejaké kvantum žiarenia. Napr. NMR je rádiové elmag. žiarenie v mag. poli (reagujú jadrá/spiny najmä vodíka a potom viem, èi je vodík z OH skupiny alebo CH3, CH2 a pod).
Luminiscenèné a fosforescenèné vyžiarenie je zriedkavejšie - tu sa z exitovaného stavu nevracia do základného, ale najskôr do hladiny s najnižšou exitaènou energiou, kde si nachví¾u "dáme kávu" a až potom dožiarime kvantum fotónov (luminiscencuia - ve¾mi krátka doba) alebo tam "prespíme, ak by sa nám zmenil spin a bolo by to proti Paulijòho vyluèovacieho princípu" a to je fosforescencia (dlhšia doba - poèkáme, kým sa spin nezmení)
Partneri, t.j. dvojice sú zoradení pod¾a hodnoty rovnovážneho napätia, tzv. REDOX-potenciálu. Napr.
Zinok => E°-Zn2+/Zn° = -0,76 V
Vodík => E°- H +/H° = 0,00 V
Meï => E°-Cu 2+/Cu° = +0,34 V
Ak mám viacero možností, že látky sa môžu oxidova alebo redukova, platí to, že beží tá reakcia, kedy partner so zápornejším potenciálom odovzdá prebytok elektrónov tomu druhému. Opaène to nejde. Najsilnejšie redukovadlá majú - potenciál a najsilnejšie oxidovadlá + potenciál (fluór - zredukuje sa na fluorid, manganistan,...)
Príklad: Ak mám meï a zinok, èo sa bude rozpúša v kyseline sírovej?
Zinok= -0,75 V vodík =0 V => Zn môže odovzda elektróny iónom H +, ktoré sa zredukujú na vodík
Meï Cu= +0,34 V vodík =0 V => Cu nemôže odovzda elektróny iónom H +, lebo tie ich majú viacej, t.j. meï sa nebude rozpúša v kyseline (musí sa prida oxidovadlo, ab yto išlo, napr. dvojchroman draselný).
SVET
DPMTF
MI
DPMTF
Elektromagnetické spektrum alebo len spektrum objektu je rozsah elektromagnetického žiarenia, ktoré objekt emituje, odráža alebo prepúša.
Infraèervené žiarenie je elektromagnetické žiarenie s vlnovou dåžkou väèšou ako vidite¾né svetlo a kratšou ako mikrovlnné žiarenie. nfraèervené žiarenie zaberá v spektre 3 dekády a má vlnovú dåžku medzi 760 nm a 1 mm, resp. energiu fotónov medzi 0,0012 a 1,63 eV. Nazýva sa tiež tepelné žiarenie.
Použitie: Infraèervené žiarenie sa èasto používa na prenos informácií na krátku vzdialenos.
Spektroskopia je detekovanie vlastností materiálu (obvykle organických zlúèenín) na základe prenikania IR žiarenia vzorkou materiálu. Rôzne molekulárne väzby pohlcujú žiarenie rôznych vlnových dåžok.
Nahrievanie. Infraèervené žiarenie sa používa ako zdroj tepla emisiou (infraèervené ohrievaèe, sauny, vypa¾ovanie farieb, odmrazovanie lietadiel, opravy asfaltových povrchov, na varenie a peèenie a pod.
Žiarenie gama (èasto písané ako grécky znak gama, γ) je vysoko energetické elektromagnetické žiarenie vznikajúce pri rádioaktívnych a iných jadrových dejoch. Žiarenie je vysoko energetické elektromagnetické žiarenie vznikajúce pri rádioaktívnych a iných jadrových dejoch.rozdiel medzi nimi je len v zdroji. Spôsobuje podobné poškodenia ako röntgenové žiarenie: popáleniny, rakovinu, mutácie.
Je nebezpeèné z dôvodu
1. vlnovej dlžky
2. velkosti energie
3. vplyvov na organizmus
Spektrum [Ti(H2O)6]3+ - je paramagnetické žiarenie v dôsledku prítopožadovaný E na podporu elektronu z nižších orbitálov . zodpovedá vlnovej dåžke ~ 500 nm.je èerveno-fialovej farby.
Spektr�
DPMTF
 Link na odborný článok o Ramanovej spektroskopii => http://www.fns.uniba.sk/uploads/media/Ram-spek-upd.pdf. To je ale moc zložité.
Link na odborný článok o Ramanovej spektroskopii => http://www.fns.uniba.sk/uploads/media/Ram-spek-upd.pdf. To je ale moc zložité.* Princíp je asi takýto: ked emitované monochromatické žiarenie jednej vlnovej dlzky asi na úrovni viditelného žiarenia dopadá na niektoré molekuly, èast žiarenia sa môže rozptýlit - môžem sledovat kolmo na smer dopadajúceho žiarenia. Ale to rozptýlené ("odrazené") žiarenie má trochu inú frekvenciu, t.j. vlnovú dĺžku. Na spektrách potom vidíme posuv. Energeticky je to asi tak, že sa rozvibrujú molekuly a tomu zodpovedajú kvantá energie prechodov medzi dvoma vibračnými stavmi.
Ramanova spektroskopia je preto nedeštruktívna metóda analýz látok (málo energetická, preto sa molekuly len "zachvejú", rozvibrujú). Porovnaním výsledkov s infraèervenou spektroskopiou - ak sa výsledky odlišujú, tak to znamená, že je možná polarizácia a môžeme usudzovať o štruktúre molekúl.(Moore. Fyz.chemia,str. 772)
Na obrázku je Ramanov spektrometer, kde je zabudovaný laser ako zdroj žiarenia a súèasne je tam aj optický mikroskop.

Raman effect allows fast, non-destructive chemical analysis of solids, powders, liquids, and gases.
MI
DPMTF
termodynamika- stavová rovnica je jednou zo zákl. rovníc termodynamiky, to je užitoèné lebo nám umožnuje pre danú zmenu jednej zo sta´vových velièín predpovedat, ako sa budú správat ostantné stavové velièiny. Stavovú velièinu môžeme napísat pre plyny okolo nás ale napríklad aj pre vnútro hviezd. najznámejšia stavová velièina je pV=NkT (p=tlak plynu, V=jeho objem, N= celkový poèet jeho èastíc ). Stavová rovnica ideálneho plynu sa niekedy zapisuje v trochu inom tvarekedy je poèet èastíc N nahradený ich molovým mnoýžstvom n. pV=nRT.
ENTALPIA. je velièina ktorou sa vyjadruje obsah energie látok zúèastnených na reakcii prebiehajúcej za nezmeneného tlaku.
vztah pre výpoèet entalpie : H=U+pV
teplo dodané sústave pri konšt. tlaku sa rovná zvýšeniu jej entalpie.
Pri reakcii hasenia páleného vápna vyjadruje rovnica.. reakcia je exotermická. dôsledkom je velmi výrazný vývoj tepla.
ENTROPIA : je fyz. velièina ktorá meria neusporiadaniost systému .je jednou zo stavových velièín v termodynamike. jej jednotkou je J/K.
jeden z najdôležitejších zákonov termodynamiky je entropia. je to druhá veta termodynamická .hvorí že entropia izoplovanej sústavy s èasom rastie.
príklad entropie je ked dáme do pohára s horúcim èajom studenú lyžièku, entropia je menšia než po istom èase kedy sa teploty vyrovnajú. to si môžme vysvetlit tým, že vnútorná energia na zaiatku prevažne sústredená v horúcom èaji sa neskôr rozdelila rovnomernejšie medzi èajom a lyžièkou.
GIBBSOVA energia: je najúèinejšou termodynamickou funkciou ktorá popisuje zmeny chem. energia a ku kt. docháídza pri biologickej oxidácii látok. ide tu o premenu energie na užitoènú prác. - je tiež kritériom priebehu jednotlivých reakcií.
MI
DPMTF
Orbitály atómu sú obsadzované vždy párom elektrónov (napr. p, ktorý je trojnásobne degenerovaný: px, py, pz), elektróny najskôr zaplnia všetky tri orbitály a až následne sa zaènú párova. Multiplicita je vlastne poèet nespárených elektrónov + 1.
Elektrón sa v skutoènosti pohybuje okolo jadra nie po obežnej dráhe, ale akoby po guli a nevieme, kde je v ktorom momente. Nevieme súèasne urèi aj polohu elektrónu aj jeho impulz (Heisenbergov princíp neurèitosti).
Preto sa zaviedla vlnová mechanika (súèas kvantovej), ktorá sa dá používa na vysvetlenie pohybových stavov elektrónov, atómov, molekúl, fotónov.
Pauliho vyluèovací princíp pri obsadzovaní orbitálov znamená, že v danom stave môžu by najviac 2 elektróny, ale s opaèným spinom.
Pri obsadzovaní hladín platí, že sa najskôr obsadia hladiny s nižšími energiami. Pri atómoch s väèším poètom elektrónov sa však vyskytujú rôzne nepravidelnosti dané tienením neutrónmi a pod.
MI
DPMTF
Periodická tabulka prvkov sa riadi vlastne týmto periodickým zákonom. Všetky prvky sú zoradené pod¾a vzrastajúcej atómovej hmotnosti.Prvky sú usporiadané do 7 radov, ktoré nazývame periódy.Prvky sú tiež umiestnené pod seba do 16 skupín A a B.
V štvrtej, piatej a v šiestej perióde sa nachádzajú prechodné prvky. Prechodné prvky majú elektrónmi obsadené aj hladiny d a preto sa nazývajú aj d - prvky.
Prvky skupín A sa nazývajú aj neprechodné prvky, ich poèet valenèných elektrónov sa zhoduje s èíslom skupiny, v ktorej sa nachádzajú.
Kovy – sem patria prvky s nízkou ionizaènou energiou – ¾ahko tvoria katióny, s kovovým leskom, elektrickou i tepelnou vodivosou, prvky, ktoré sú kujné, ažné. Napríklad alkalické kovy, kovy alkalických zemín.
Elektronegativita je v chémií vlastnos atómu priahova elektróny tvoriace chemickú väzbu. Elektronegativita prvkov v periodickej sústave prvkov rastie z¾ava doprava v rámci periód.
MI
DPMTF
MI
DPMTF
termodynamika- stavová rovnica je jednou zo zákl. rovníc termodynamiky, to je užitoèné lebo nám umožnuje pre danú zmenu jednej zo sta´vových velièín predpovedat, ako sa budú správat ostantné stavové velièiny. Stavovú velièinu môžeme napísat pre plyny okolo nás ale napríklad aj pre vnútro hviezd. najznámejšia stavová velièina je pV=NkT (p=tlak plynu, V=jeho objem, N= celkový poèet jeho èastíc ). Stavová rovnica ideálneho plynu sa niekedy zapisuje v trochu inom tvarekedy je poèet èastíc N nahradený ich molovým mnoýžstvom n. pV=nRT.
ENTALPIA. je velièina ktorou sa vyjadruje obsah energie látok zúèastnených na reakcii prebiehajúcej za nezmeneného tlaku.
vztah pre výpoèet entalpie : H=U+pV
teplo dodané sústave pri konšt. tlaku sa rovná zvýšeniu jej entalpie.
Pri reakcii hasenia páleného vápna vyjadruje rovnica.. reakcia je exotermická. dôsledkom je velmi výrazný vývoj tepla.
ENTROPIA : je fyz. velièina ktorá meria neusporiadaniost systému .je jednou zo stavových velièín v termodynamike. jej jednotkou je J/K.
jeden z najdôležitejších zákonov termodynamiky je entropia. je to druhá veta termodynamická .hvorí že entropia izoplovanej sústavy s èasom rastie.
príklad entropie je ked dáme do pohára s horúcim èajom studenú lyžièku, entropia je menšia než po istom èase kedy sa teploty vyrovnajú. to si môžme vysvetlit tým, že vnútorná energia na zaiatku prevažne sústredená v horúcom èaji sa neskôr rozdelila rovnomernejšie medzi èajom a lyžièkou.
GIBBSOVA energia: je najúèinejšou termodynamickou funkciou ktorá popisuje zmeny chem. energia a ku kt. docháídza pri biologickej oxidácii látok. ide tu o premenu energie na užitoènú prác. - je tiež kritériom priebehu jednotlivých reakcií.
MI
DPMTF
Orbitály atómu sú obsadzované vždy párom elektrónov (napr. p, ktorý je trojnásobne degenerovaný: px, py, pz), elektróny najskôr zaplnia všetky tri orbitály a až následne sa zaènú párova. Multiplicita je vlastne poèet nespárených elektrónov + 1.
Elektrón sa v skutoènosti pohybuje okolo jadra nie po obežnej dráhe, ale akoby po guli a nevieme, kde je v ktorom momente. Nevieme súèasne urèi aj polohu elektrónu aj jeho impulz (Heisenbergov princíp neurèitosti).
Preto sa zaviedla vlnová mechanika (súèas kvantovej), ktorá sa dá používa na vysvetlenie pohybových stavov elektrónov, atómov, molekúl, fotónov.
Pauliho vyluèovací princíp pri obsadzovaní orbitálov znamená, že v danom stave môžu by najviac 2 elektróny, ale s opaèným spinom.
Pri obsadzovaní hladín platí, že sa najskôr obsadia hladiny s nižšími energiami. Pri atómoch s väèším poètom elektrónov sa však vyskytujú rôzne nepravidelnosti dané tienením neutrónmi a pod.
MI
DPMTF
Periodická tabulka prvkov sa riadi vlastne týmto periodickým zákonom. Všetky prvky sú zoradené pod¾a vzrastajúcej atómovej hmotnosti.Prvky sú usporiadané do 7 radov, ktoré nazývame periódy.Prvky sú tiež umiestnené pod seba do 16 skupín A a B.
V štvrtej, piatej a v šiestej perióde sa nachádzajú prechodné prvky. Prechodné prvky majú elektrónmi obsadené aj hladiny d a preto sa nazývajú aj d - prvky.
Prvky skupín A sa nazývajú aj neprechodné prvky, ich poèet valenèných elektrónov sa zhoduje s èíslom skupiny, v ktorej sa nachádzajú.
Kovy – sem patria prvky s nízkou ionizaènou energiou – ¾ahko tvoria katióny, s kovovým leskom, elektrickou i tepelnou vodivosou, prvky, ktoré sú kujné, ažné. Napríklad alkalické kovy, kovy alkalických zemín.
Elektronegativita je v chémií vlastnos atómu priahova elektróny tvoriace chemickú väzbu. Elektronegativita prvkov v periodickej sústave prvkov rastie z¾ava doprava v rámci periód.
MI
DPMTF
SVET
DPMTF
SVET
DPMTF
SVET
DPMTF
2. Ak vyjde èas, tak ústne, ab ste vedeli nieèo o spektrách
SVET
DIPLPRAC
SVET
DIPLPRAC